En resumen: Las vacunas anticovid se desarrollaron en procesos abreviados con respecto a otros medicamentos, pero son productos farmacéuticos que pasaron por todas las fases de desarrollo que garantizan su seguridad. Este proceso se conoce como autorización de uso en emergencia. No es cierto que sean sustancias experimentales.
Una plataforma de desinformación antivacunas sostiene falsamente que las personas vacunadas son parte de una última etapa clínica de experimentación.
Todas las vacunas usadas en Costa Rica han concluido ya con la fase 3 de estudios clínicos. Este es un requisito para solicitar autorizaciones expeditas en agencias reguladoras como la estadounidense o la europea.
El hecho de que las vacunas hubieran sido desarrolladas y producidas bajo autorizaciones de emergencia no quiere decir que las casas farmacéuticas hubieran evitado salvaguardas a la seguridad y la salud.
La desinformación ha sido divulgada recurrentemente en una página de desinformación en Facebook, repetidas por una médica general de apellido Campos. Doble Check solicitó información a la médica que respaldara sus afirmaciones pero no contestó.
La desinformación
“Eso no es vacuna, (…) ni siquiera las casas farmacéuticas dicen que es una vacuna, lo que se dice es que es una vacuna no aprobada en fase 3”, afirma falsamente Campos.
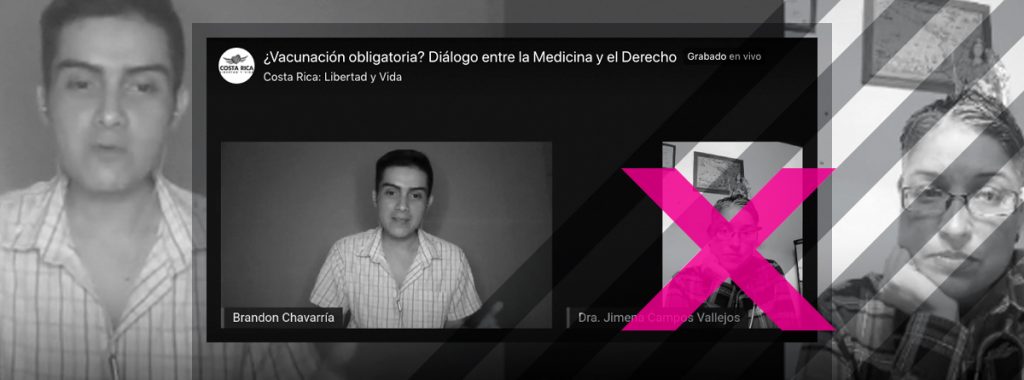
La médica expresó estas falsedades en un conversatorio en vivo que mantuvo con un miembro de un grupo antivacunas de Facebook, Brandon Chavarría Chaves. Él es licenciado en derecho y candidato a diputado por Guanacaste por el Partido Nueva República.
La médica Campos dijo que no es hasta este momento que las vacunas anticovid están en su fase 3 de experimentación en seres humanos. La médica incluso conjeturó sin ninguna base que hay personas vacunadas a las que les podrían estar aplicando placebos.
“Gente que dice, a mí no me duele el brazo, me aplicaron la vacuna y yo no sentí nada, entonces eso podrían ser personas que participan y que están recibiendo un placebo y no se están dando cuenta”, afirma.
En el conversatorio, Campos aportó la visión médica y Brandon Chavarría expresó opiniones legales por las que considera que la vacuna debería aplicarse solo con un consentimiento informado. Al ser contactado por Doble Check, el activista admitió desconocer que las afirmaciones aportadas por Campos eran falsas al momento del conversatorio.
Chavarría aclara que su participación en el grupo es como ciudadano y que esta vinculación no está asociada a su militancia en Nueva República. El activista evitó considerarse «antivacunas» y se definió, más bien, como un promotor de la libertad de las personas. Su agrupación en Facebook se expresa abiertamente en contra de la vacunación contra la COVID-19.

El tono general de la desinformación, incluso en el caso de Chavarría, es de desconfianza debida a la rapidez con la que se desarrolló la vacuna de Pfizer.
Autorizaciones de emergencia no se dan a sustancias experimentales
Es cierto que la vacuna anticovid de Pfizer llegó al público con una autorización de uso de emergencia (EUA, por sus siglas en inglés) emitida por la autoridad de medicamentos de Estados Unidos. La vacuna de AstraZeneca salió con un procedimiento similar llamado autorización condicional de mercado (ACM, por sus siglas en inglés) emitida por la autoridad europea.
Grupos antivacunas o que promueven la indecisión en el público usan el argumento de las aprobaciones de emergencia para argumentar que estos fármacos son experimentales. No lo son.
Las vacunas usadas en Costa Rica han concluido ya con la fase 3 de los estudios clínicos, que es la última etapa experimental. Esto quiere decir que ya se aplicaron en grandes grupos de personas para evaluar su eficacia y seguridad. Este es un requisito para solicitar la EUA o ACM. Estos estudios están disponibles aquí y aquí.
Se pueden continuar haciendo estudios clínicos para ampliar los datos, pero ya han cumplido con los requisitos necesarios.
De hecho, todos los medicamentos aprobados de manera estándar o en su versión abreviada continúan siendo monitoreados por efectos muy raros o de largo plazo, en lo que se conoce como la fase 4. Es decir, continúa la vigilancia con respecto a posibles efectos no percibidos en etapas experimentales.
En agosto del 2021, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) brindó la aprobación de la vacuna de Pfizer-BioNtech para ser comercializada como «Comirnaty». En enero del 2022, esa entidad reguladora autorizó la comercialización de la inoculación de Moderna con el nombre de «Spikevax».
¿Pierde rigor científico un medicamento con autorización de emergencia?
No lo hace. Esta autorización se da en casos excepcionales cuando el tiempo apremia, como la actual crisis sanitaria.
Este permiso no disminuye la rigurosidad del análisis ni la calidad, eficacia y seguridad exigidas del producto. Sí implica la necesidad de invertir mayores recursos económicos y la coordinación estratégica de diversos sectores.
¿Cómo se agilizan los procesos? Uno de los efectos prácticos es la posibilidad de extrapolar algunos resultados de estudios anteriores realizados con vacunas estrechamente relacionadas. Por ejemplo, si hubiera estudios toxicológicos preclínicos de vacunas similares, no es necesario realizarlos específicamente para la nueva vacuna antes de pasar a la fase clínica.
También se pueden utilizar diseños adaptados de fase clínica. Estos buscan hacer más rápida la toma de decisiones basándose en resultados preliminares de otros ensayos clínicos similares o del mismo estudio clínico, con el fin de reducir el número y duración del estudio. Estas modificaciones se hacen teniendo muy en cuenta el rigor estadístico para que los estudios no pierdan poder.
¿La falta de reacción a vacuna es muestra de placebo?
No. No hay evidencia de que existan personas que estén recibiendo placebos en lugar de vacunas. Las reacciones a la vacunación se presentan en distintos grados en diferentes personas, lo cual ha sido ampliamente estudiado e informado por las casas farmacéuticas.
Hay una lista de efectos secundarios conocidos que se presentan en diferente frecuencia y que tienen diversos grados de severidad. En general, los efectos más leves son los más comunes y según la OMS incluyen: dolor y enrojecimiento del brazo, fiebre leve, cansancio, dolores de cabeza, músculos y articulaciones.
En Costa Rica, el Centro Nacional de Farmacovigilancia ha recibido, al 2 de mayo, 3.536 reportes de eventos asociados a la vacunación contra la COVID-19. Esta cifra representa el 0,4% de las personas vacunadas a ese periodo. El dolor de cabeza, la fiebre y el dolor en el punto de aplicación son los más comunes.
Se han reportado 3 casos de especial interés (0,0003%): síndrome de Guillain-Barré, miocarditis y flebitis.
También hubo 14 notificaciones de casos graves (0,0015%). Estos reportes no implican una relación causal directa con de los eventos con la vacunación. Entre estos casos, 10 se han recuperado (5 se calificaron como probablemente asociados a la vacunación) y 4 han fallecido. Esos cuatro casos 4 fueron calificados como una relación improbable con la vacunación y vinculados con condiciones de fondo de los pacientes.
La aprobación de vacunas en Costa Rica
Los países que no tienen su propia agencia reguladora, como Costa Rica, suelen basarse en los criterios de una o varias de agencias reguladoras estrictas cuando desean considerar y eventualmente brindar los permisos de comercialización.
Entre estas agencias están la autoridad estadounidense de medicamentos (FDA, por sus siglas en inglés) o la europea (EMA, por sus siglas en inglés).
Todas las vacunas incluídas en el Esquema Nacional de Vacunación y otras que se distribuyen en Costa Rica deben estar inscritas ante el Ministerio de Salud. Estas son consideradas como medicamentos, de tal forma que son incluidas en el Decreto Ejecutivo Nº 39433-S.
La normativa establece las condiciones para que el Ministerio de Salud pueda considerar reconocer informes concluyentes de estudios clínicos y preclínicos de seguridad y eficacia, bioequivalencia o biosimilitud, como parte del registro sanitario de los medicamentos y en cuyo artículo 2, cita las Agencias Reguladoras Estrictas aceptadas.
Nota del editor: Silvia Molina es Doctora en Microbiología e Inmunología de la Universidad de Bordeaux, Francia. Desde el 2008, es docente de la cátedra de Enfermedades Infecciosas y del departamento de Bioquímica de la Escuela de Medicina de la UCR. También es investigadora del programa de Epidemiología del Cáncer del Instituto de Investigaciones en Salud (INISA) de la UCR. Ella forma parte de un proyecto de colaboración entre la Escuela de Medicina de la UCR y Doble Check para verificar desinformación en materia de salud.
Este chequeo fue actualizado el 20 de mayo del 2022 para incluir las autorizaciones de comercialización de la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) para las vacunas contra la COVID-19 de Pfizer-BioNtech y Moderna.